Lietuvos chirurgija ISSN 1392–0995 eISSN 1648–9942
2022, vol. 21(3–4), pp. 236–242 DOI: https://doi.org/10.15388/LietChirur.2022.21.71
Epidurinės seromos, susidariusios atlikus kranioplastiką, gydymo iššūkiai: atvejo analizė ir literatūros apžvalga
Živilė Žalalytė
Neurochirurgijos skyrius, Respublikinė Vilniaus universitetinė ligoninė, Vilnius, Lietuva
Department of Neurosurgery, Republican Vilnius University Hospital, Vilnius, Lithuania
El. paštas zalalyte.zivile@gmail.com
Gytis Šustickas
Neurochirurgijos skyrius, Respublikinė Vilniaus universitetinė ligoninė, Vilnius, Lietuva
Department of Neurosurgery, Republican Vilnius University Hospital, Vilnius, Lithuania
Medicinos fakultetas, Utenos kolegija, Utena, Lietuva
Faculty of Medicine, Utena University of Applied Sciences, Utena, Lithuania
E-mail: gytis.sustickas@gmail.com
Abstract. Cranioplasty has its risks and complications as all surgical procedures. Treatment of complications are poorly known and could raise significant challenges. One of these complications is epidural fluid collection (EFC). We presented a case of recurrence EFC with deterioration of consciousness. A decompressive craniectomy was performed after rotten subdural hematoma and craniectomy so a cranioplasty was done after more than a half year of cured infection. An EFC occurred next day and one month after the cranioplasty. Due to many repetitive surgeries and head computed tomography scans a vacuum drainage system was formed. After twelve days of treatment the patient improved and the EDC disappeared with this system. We tried to search possible causes and treatment methods for EFC in literature. However, the pathogenesis is still unknown and treatment is only symptomatic.
Key words: cranioplasty, cranioplasty complications, epidural fluid collection, vacuum drainage system.
Received: 2022/05/17. Accepted: 2022/07/25.
Copyright © 2022 Živilė Žalalytė, Gytis Šustickas. Published by Vilnius University Press. This is an Open Access article distributed under the terms of the Creative Commons Attribution Licence, which permits unrestricted use, distribution, and reproduction in any medium, provided the original author and source are credited.
Įžanga
Dekompresinė kraniektomija yra chirurginė procedūra, skirta intrakranijiniam slėgiui sumažinti, pašalinant kaukolės kaulą. Ši procedūra dažniausiai atliekama pacientų, patyrusių galvos smegenų traumą ar insultą, funkcinėms išeitims pagerinti ir mirštamumui sumažinti. Retais atvejais, esant epidurinio ar subdurinio tarpo empiemai ir kraniotominio lopo osteomielito požymių, kaulas šalinamas dėl prastos jo mitybos, antibiotikų penetracijos ir su tuo susijusios ilgalaikės infekcijos. Išpjovus kaulą, mažėja infekcijos persistavimas dėl prastos antibiotikų penetracijos į kraniotomijos lopą. Po minėtos procedūros išgyvenusiems pacientams vėliau reikia atlikti kranioplastiką (KP) ir atkurti normalią kaukolės anatomiją bei intrakranijinę homeostazę. Šiai procedūrai, kaip ir kitoms chirurginėms intervencijoms, būdinga rizika ir galimos komplikacijos, kurios mažai žinomos ir gali kelti nemažų gydymo iššūkių. Straipsnyje siekiama aptarti vieną iš klinikinių atvejų ir apžvelgti mokslinės literatūros duomenis nagrinėjama tema.
Atvejo aprašymas
53 m. vyras sumuštas gatvėje ir greitosios medicinos pagalbos atvežtas į Priėmimo skyrių. Pacientui atlikta galvos kompiuterinė tomografija (GKT). Rasta: poūmė, stora, apie 16 mm dydžio subdurinė hematoma (SDH) dešinėje pusėje konveksitaliai ir ūmi nedidelė SDH kairėje pusėje frontoparietaliai. Vidurio struktūrų dislokacija (VSD) į kairę – minimali. Kairėje – kaukolės skliauto linijinis lūžis. Nustatyta nosies kaulų, nosies pertvaros, dešiniojo viršutinio žandikaulio kaktinės ataugos ir kūno, sinuso sienelių lūžių, dešinės akiduobės medialinio krašto lūžių ir dešiniojo skruostinio lanko lūžių (1 pav.). 2020 m. liepos mėn. pacientas skubos tvarka operuotas: atlikta dešinė kraniotomija, pašalinta hematoma. Atlikus kontrolinę GKT, buvo matyti, kad pašalinta didžioji hematomos dalis (2 pav.). Pacientas konsultuotas veido ir žandikaulio chirurgo, skubus chirurginis gydymas neindikuotas. Praėjus 3 savaitėms, pacientas, esant gerai funkcinei ir neurologinei būklei, tolesnio gydymo perkeltas į slaugos ligoninę, vėliau išleistas gydytis ambulatoriškai.
1 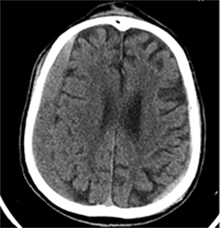 2
2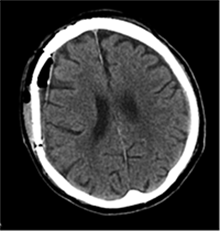 3
3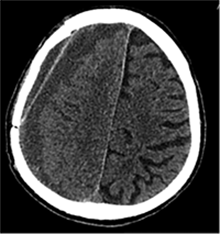
1 pav. Prieš pirmąją operaciją (poūmė, stambi, iki 16 mm SDH apie dešinįjį pusrutulį, ūmi nedidelė SDH kairėje F-P; VSD į kairę ~3 mm)
2 pav. Po pirmosios operacijos (didžioji hematomos dalis pašalinta, VSD be dislokacijos)
3 pav. Prieš antrąją operaciją (25 mm storio hipodencinė juosta virš dešiniojo smegenų pusrutulio, esant 8 mm dislokacijai į kairę; įtarta lėtinė SDH dešinėje)
Po 2 savaičių pacientas rastas parkritęs kieme. Buvo matyti kraujuojanti žaizda. Pacientas pakartotinai hospitalizuotas į Neurochirurgijos skyrių. Atlikus GKT, nustatyta 25 mm storio hipodencinė juosta virš dešiniojo smegenų pusrutulio ir 8 mm vidurinių smegenų struktūrų dislokacija (VSD) į kairę (3 pav.). Įtariant lėtinę SDH dešinėje pusėje, pacientas reoperuotas, atliekant rekraniotomiją. Operacijos metu ant kietojo smegenų dangalo (KSD) rasta fibrino, jis pašalintas. Pravėrus KSD, rastas drumstas turinys, nesant aiškių pūlių, ir stora kapsulė. Gausiai praplauta šiltu fiziologiniu tirpalu subduraliai. Kaulinis lopas grąžintas (4 pav.). Po operacijos pacientas pradėjo skųstis stipriu galvos skausmu, tapo vangus. GKT pakartota. Įtarta empiema, nustatyti oro tarpai subduraliai, galvos smegenų VSD – 6 mm. Praėjus 12 dienų po antros operacijos, pacientas operuotas pakartotinai. Operacijos metu atlikta rekraniotomija. Epiduriniame ir subduriniame tarpuose rasta pūlių ir fibrino. Pūliai ir fibrinas pašalinti, paimtas bakteriologinis pasėlis. Žaizda gausiai praplauta šiltu fiziologiniu tirpalu. Kaulinis lopas negrąžintas, minkštieji audiniai susiūti (5 pav.). Po operacijos paciento būklė stabilizavosi. Bakteriologiniame pasėlyje negausiai užaugo E. coli, jautri ampicilinui. Nesant teigiamo efekto gydant ampicilinu, dar 2 savaites pacientui skirta gentamicino. Praėjus 3 savaitėms po trečios operacijos, pacientas perkeltas į slaugos ligoninę palaikomojo gydymo.
4 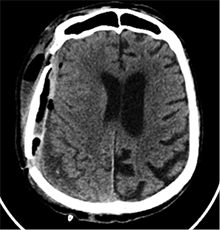 5
5 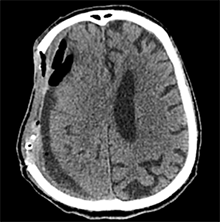 6
6 
4 pav. Po antrosios operacijos (didžioji hematomos dalis pašalinta; VSD sumažėjo nuo 8 iki 5 mm)
5 pav. Po trečiosios operacijos (didžioji hematomos dalis pašalinta, nustatyta empiema, oro intarpų, VSD sumažėjo nuo 6 mm iki 4 mm)
6 pav. Perforacijos KPL
Po pusės metų vyras konsultuotas ambulatoriškai planine tvarka. Atlikus GKT, nustatyta nedidelė lėtinė SDH dešinėje pusėje parietaliai. Po mėnesio suplanuota atlikti KP. Operacijos metu suformuotas kranioplastikos lopas (KPL) iš kraniocemento. Atlikta daugybinių KPL perforacijų (6 pav.), KPL fiksuotas prie kaukolės 10 siūlių. Kitą dieną po operacijos atlikta kontrolinė GKT (7 pav.): po KPL nustatyta hemostatinė medžiaga ir ~20 mm storio ūminė epidurinė hematoma. Vidurio struktūrų dislokacija į kairę – iki 3 mm. Dešinėje pusėje, poodyje – pooperacinė sankaupa su pakraujavimu. Tą pačią dieną atlikta skubi operacija epidurinei ir periostinei hematomoms pašalinti. Aktyvaus kraujavimo operacijos metu nenustatyta. KPL grąžintas, minkštieji audiniai susiūti (8 pav.). Po operacijos paciento būklė buvo stabili, patologinių neurologinių simptomų nenustatyta. Praėjus 2 savaitėms, esant sklandžiai pooperacinei eigai, vyras perkeltas į slaugos ligoninę.
7 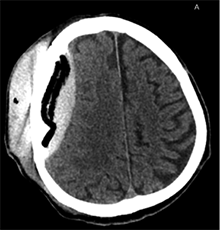 8
8 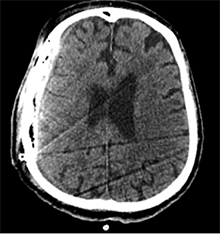 9
9 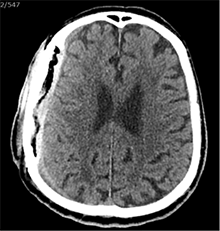
7 pav. Po ketvirtosios operacijos (kranioplastikos) (kraniolopo padėtis gera; po kraniolopu ūminė EDH su hemostatine medžiaga, VSD į kairę – iki 3 mm; dešinėje – poodyje pooperacinė sankaupa su pakraujavimu)
8 pav. Po penktosios operacijos (epidurinė ir periostinė hematomos pašalintos; VSD nėra)
9 pav. Po šeštosios operacijos (teigiami pooperaciniai pakitimai, smarkiai sustorėjęs kietasis smegenų dangalas, tarpas tarp kaulo ir kietojo smegenų dangalo; VSD nėra)
Praėjus dar 2 sav., pacientas iš slaugos ligoninės atvežtas dėl vangumo, dezorientacijos, nerišlios ir sulėtėjusios kalbos. Atlikus GKT, dešinėje pusėje po kraniotomijos lopu įtarta poūmė (ūmi) epidurinė hematoma, nesant VSD. Per parą pacientas operuotas. Operacijos metu po minkštaisiais audiniais rasta kraujo sankaupa su seroziniu komponentu, paimtas bakteriologinis pasėlis. Po KPL rasta krešulių su skystu krauju ir seroziniu komponentu. Paimtas antras bakteriologinis pasėlis, įtariant infekciją. Hematoma (seroma) pašalinta. Žaizda plauta mažos koncentracijos betadinu ir fiziologiniu tirpalu. Kraujavimo iš KSD nepastebėta. Nuspręsta KPL grąžinti – labiau tikėtina epidurinės seromos (EDS) diagnozė. Siekta uždaryti „negyvąjį“ epidurinį tarpą, pakabinant KSD centre prie KPL siūlais, tačiau KSD buvo nepaslankus, tampriai priaugęs prie smegenų. Atlikus kontrolinę GKT (9 pav.), nustatyta teigiamų pooperacinių pakitimų, smarkiai sustorėjęs KSD, tarpas tarp KPL ir KSD. VSD nenustatyta. Po operacijos paciento bendroji būklė buvo stabili. Reakcija buvo kiek sulėtėjusi, tačiau vyras gebėjo atsakyti į elementarius klausimus. Teigiama klinikinė dinamika. Po savaitės pacientas tapo labai vangus, sulėtėjo, skundėsi silpnumu, kalbėjo nesklandžiai. Pakartojus GKT (10 pav.), nustatyta padidėjusi epidurinė skysčio sankaupa, panaši į mišraus tankio hematomą (apie 64 ml tūrio) dešinėje pusėje frontotemporoparietaliai, padidėjusi VSD į kairę – iki 4 mm. Kadangi pacientas per tą patį randą jau operuotas 6 kartus, o po operacijų pastebimos vis atsinaujinančios pakartotinės EDS, priimtas sprendimas neskirti operacinio gydymo. KPL turėjo daugybinių perforacijų, todėl nuspręsta atlikti subgalinio tarpo punkciją, tikintis, kad per perforacijas išbėgs EDS. Atlikus punkciją, gauta 20 ml serohemoraginio skysčio. Po procedūros paciento būklė pagerėjo, jis tapo kiek aktyvesnis, tačiau efektas nebuvo patenkinamas. Kitą dieną nuspręsta punktuoti pakartotinai, gauta 4 ml serohemoraginio skysčio. Tūris buvo nepakankamas teigiamam efektui gauti. Priimtas sprendimas skirti lašinių infuzijų ir švelnią osmoterapiją neurologinei simptomatikai sumažinti. Punkcijos nedavė norimo efekto, todėl nuspręsta suformuoti poodinę neigiamo slėgio drenažinę sistemą po minkštųjų audinių lopu. Į subgalinį tarpą įvestas 20G periferinės venos kateteris, fiksuotas prie odos ir sujungtas su uždara vakuumine sistema, tikintis nuolatinio drenavimosi smegenų kompresijai sumažinti. Per 5 lovadienius išsiskyrė apie 50 ml serohemoraginio skysčio. Atlikus kontrolinę GKT, buvo matyti teigiama dinamika (11 pav.). Dėl infekcijos profilaktikos vakuuminė sistema pakeista 2 kartus. Įvedus vakuuminę sistemą, po 12 lovadienių paciento būklė pagerėjo, jis tapo aktyvesnis, į klausimus atsakydavo prasmingai, paliepimus vykdydavo visomis galūnėmis. Vakuuminė sistema pašalinta. Po 2 dienų atlikta GKT (12 pav.). EDS dešinėje pusėje regresavo, smegenų kompresijos nenustatyta. Esant stabiliai būklei ir teigiamai dinamikai, pacientas grąžintas į slaugos ligoninę.
10 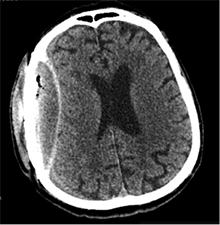 11
11 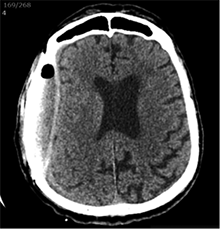 12
12 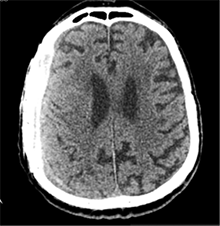
10 pav. Bėgant laikui, padidėjusi EDS (dešinėje F-T-P, padidėjusi VSD į kairę iki 4 mm)
11 pav. Implantavus vakuuminę sistemą su PVK (dešinė F-T-P EDS dinamikoje sumažėjusi; išlieka nežymi VSD)
12 pav. Dešinė F-T-P EDS dinamikoje sumažėjusi (VSD nematyti)
Diskusija
EDS patogenezė
Mokslinėje literatūroje duomenų apie EDS labai mažai. Per pastaruosius penkerius metus pristatyti vos keli tyrimai, kuriuose aptariama EDS, susidariusi atlikus KP. Remiantis D. Shepetovsky ir bendraautorių atlikta metaanalize, galima teigti, kad dažniausiai KP komplikuojasi infekcija, intracerebrine hematoma, kaulo rezorbcija ir tik tada EDS [1]. EDS dažnis, tyrimų duomenimis, svyruoja nuo 4,6 proc. iki 41,8 proc. [1–5]. EDS išsivystymo patogenezė iš esmės nėra aiški. Tyrėjų manymu, EDS gali susidaryti likvorui pereinant per KSD defektus. Kai KSD yra kalcifikuotas ir dangalo rigidiškumas neleidžia įvykti smegenų reekspancijai, susidaro didelis „negyvasis tarpas“ (angl. dead space) [6]. Kodėl įvyksta KSD kalcifikacija, nėra aišku, tačiau mokslinėje literatūroje aprašyta vaikų intrakranijinių hematomų, kurių siena prie KSD pradeda kalcifikuotis nuo hematomos atsiradimo praėjus 1 mėn. [7]. Kita EDS susidarymo hipotezė sietina su epidurinėje ertmėje susiformavusiais oro burbuliukais, sukeliančiais uždegiminį procesą, dėl kurio gali susidaryti eksudatų. Mokslinės literatūros duomenimis, oro burbuliukai, susiformavę po operacijos epiduriniame tarpe, padidina EDS atsiradimo tikimybę net 12,5 kartų [3]. Manoma, kad eksudatų susidaro per KSD defektus, per kuriuos teka likvoras. Eksudatų gali susidaryti ir dėl supjaustyto antkaulio ir raumens ar pažeisto KSD, atliekant KP [8]. Straipsnyje aptariamu atveju aiškios KSD kalcifikacijos nebuvo matyti, tačiau dangalas buvo sustorėjęs. KSD nebuvo makroskopiškai pažeistas ar prapjautas operacijos metu, tačiau dėl išsivysčiusio potrefinacinio sindromo (po kraniektomijos dėl slėgių skirtumų buvo įkritęs minkštųjų audinių lopas), atlikus KP, susidarė didelis „negyvasis tarpas“. Šeštos operacijos metu KSD bandyta pritraukti prie KPL siūlais, tačiau dėl dangalo sustorėjimo „negyvasis tarpas“ sumažintas nedaug, taigi KSD reekspancija neįvyko. Galima manyti, kad EDS susidarė dėl minkštųjų audinių reakcijos į KP cementą, nes reoperacijų metu pastebėtas difuzinis kraujavimas iš minkštųjų audinių KP cemento kontakto su minkštaisiais audiniais ribose. Ši EDS susidarymo hipotezė mokslinėje literatūroje dar nėra aprašyta. Priešingai – EDS dažniau nustatyta atliekant KP su autologiniu kaulu negu su KP cementu [5, 9]. Minėtina, kad mokslinėje literatūroje aprašytas atvejis, kai pacientui pasireiškė alerginė reakciją į kranioplastinį cementą, t. y. ištirtoje EDS buvo padidėjęs IgG titras [10].
Fenestracijų reikšmė
Dėl anksčiau gydytų EDS, susidariusių atlikus KP, klinikinėje praktikoje KPL buvo atlikta daugybinių perforacijų. Mokslinės literatūros duomenimis, KPL, turinčio fenestracijų, daug geresnės išeitys negu KPL, neturinčio fenestracijų [11], nes EPS susisiekia su subgaliniu tarpu ir dėl slėgių gradiento rezorbuojasi į minkštuosius audinius. Per padarytas skylutes EDS susisiekia su subgaliniu tarpu, seroma labiau kaupiasi po minkštaisiais audiniais negu epiduraliai. Nustatyta, kad aponeurozei būdinga gera rezorbcija, todėl EDS linkusios regresuoti [12].
Dėl daugybinių perforacijų pacientą nuspręsta punktuoti, tikintis, kad pavyks sumažinti EDS tūrį. EDS buvo serohemoraginė, todėl prireikė laiko, kol ji suskystėjo ir visiškai pasišalino per įvestą vakuuminę sistemą su periferinės venos kateteriu. Taip išvengta septintos operacijos ir visiškai pašalinta EDS. Mokslinėje literatūroje minėta gydymo taktika vakuumine poodine sistema nėra aprašyta, tačiau esama rekomendacijų atlikus KP implantuoti subgalinį dreną per kontraperturą EDS prevencijai [4]. Šio dreno implantavimas, mokslinės literatūros duomenimis, statistiškai reikšmingai sumažina su EDS susijusias komplikacijas [13]. Galima manyti, kad aptartąją taktiką pasirinkus ketvirtos operacijos metu, galimai būtų pavykę išvengti dviejų operacijų ir keturių GKT. Kita vertus, mokslinėje literatūroje dažnai aprašoma savaiminė EDS rezorbcija. Manoma, kad EDS reikia šalinti maždaug 30 proc. pacientų, nes likusieji pacientai EDS gerai toleruoja [14].
EDS rizikos veiksniai
Mokslinėje literatūroje išskiriama įvairių rizikos veiksnių EDS susidaryti. Pastebėta, kad vyriškoji lytis padidina EDS susidarymo tikimybę iki 5,5 kartų [3]. S. pil Kimo ir bendraautorių duomenimis, dažniausiai EDS susiformuoja vidutinio amžiaus asmenims (50,7 %), palyginti su jaunais (42,9 %) ir senyvais (34,6 %) pacientais [5]. Šiuos rezultatus galima paaiškinti atitinkamais galvos smegenų traumos demografiniais rezultatais (dažniausiai pacientai yra vidutinio amžiaus vyrai [15]). Kaip nurodoma mokslinėje literatūroje, KP rekomenduojama atlikti 3–6 mėn. laikotarpiu, po infekcijos – ne anksčiau negu po 6 mėn. [5]. Minėtų rekomendacijų laikytasi ir aptariamuoju atveju, nors esama tyrimų, kuriuose KP atlikta 7 dienų ar daugiau negu 10 mėn. laikotarpiu, o pateikiami rezultatai yra skirtingi [2, 3, 5, 16]. M. R. Gooch ir kt. [17] atliktame tyrime laikas iš viso neturėjo reikšmės. Minėtina, kad vėliau atliekama KP padidina kalcifikacijos tikimybę. Panašūs rezultatai analizuotose studijose pastebimi ir lyginant operacijos laiką, atliekant KP: trumpesnis laikas mažina EDS susidarymo tikimybę, nors kliniškai reikšmingo skirtumo nenustatyta [2, 3, 5]. Statistiškai reikšmingai didesnę tikimybę EDS susidaryti turi oro burbuliukų susiformavimas, KSD kalcifikacija, likvoro tekėjimas operacijos metu [3, 5, 8]. EDS atsiradimas tiesiogiai koreliuoja ir su KPL dydžiu [5], o J. S. Parko ir bendraautorių [18] atliktame tyrime – ir su infekcijos atsiradimo tikimybe.
Straipsnyje aptariamu atveju paciento KPL skirtinas mažiausiai (75 cm2) grupei, kuriai būdinga minimali infekcijos atsiradimo rizika (13 pav.), tačiau operacijos metu vis tiek buvo paimtas mikrobiologinis pasėlis infekcijai ekskliuduoti. Mokslinėje literatūroje taip pat pristatomas siekis tirti skirtingų pirminių galvos smegenų hematomų, po kurių reikėjo atlikti kraniektomiją, koreliaciją su EDS, tačiau reikšmingų rezultatų negauta [8].
Išvados
EDS – mažai ištirta KP komplikacija. Šios komplikacijos dažnis mokslinėje literatūroje nurodomas skirtingai. Gydant minėtą patologiją labai svarbu atkreipti dėmesį į daugelį mūsų išskirtų faktorių. Mokslinėje literatūroje aprašoma įvairių rizikos veiksnių, tačiau, galima manyti, kad labiausiai EDS riziką (12,5 karto) didina oro burbuliukai epiduraliai, matomi atlikus GKT po operacijos. Tikslių gydymo rekomendacijų nėra, tačiau, atliekant KP, EDS profilaktikai mokslinėje literatūroje rekomenduojama atlikti KPL fenestracijas ir išvesti subgalinį dreną.
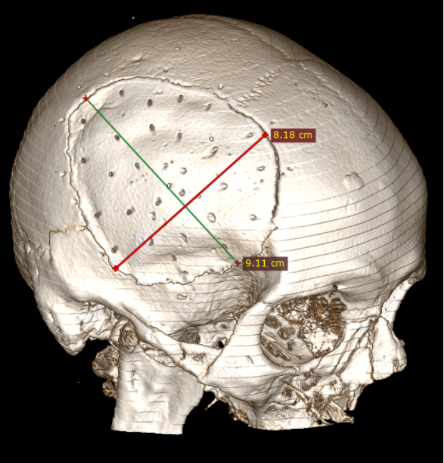
13 pav. Kranioplastikos lopo dydis (iki 75 cm2)
Literatūra
1. Shepetovsky D, Mezzini G, Magrassi L. Complications of cranioplasty in relationship to traumatic brain injury: a systematic review and meta-analysis. Neurosurgical Review 2021; 44(6): 3125–3142.
2. Kim YM, Park T, Lee SP, Baek JW, Ryou KS, Kim SH. Optimal Timing and Complications of Cranioplasty: A Single-Center Retrospective Review of 109 Cases. J Neurointensive Care 2020; 3(2): 48–57.
3. Lee JW, Kim JH, Kang HI, Moon BG, Lee SJ, Kim JS. Epidural Fluid Collection after Cranioplasty: Fate and Predictive Factors. J Korean Neurosurg Soc 2011; 50(3): 231–234.
4. Bobinski L, Koskinen LOD, Lindvall P. Complications following cranioplasty using autologous bone or polymethylmethacrylate –retrospective experience from a single centre. Clin Neurol Neurosurg 2013; 115(9): 1788–1791.
5. pil Kim S, Kang DS, Cheong JH, Kim JH, Song KY, Kong MH. Clinical Analysis of Epidural Fluid Collection as a Complication after Cranioplasty. J Korean Neurosurg Soc 2014; 56(5): 410–418.
6. Hyoung-Joon C, Hyeong-Joong Y. Efficacy and Safety of Early Cranioplasty, at Least Within 1 Month. J Craniofac Surg 2011; 22(1): 203–207.
7. Chang JH, Choi JY, Chang JW, Park YG, Kim TS, Chung SS. Chronic epidural hematoma with rapid ossification. Child’s Nervous System 2002; 18(2): 712–716.
8. Jeong SH, Wang US, Kim SW, Ha SW, Kim JK. Symptomatic Epidural Fluid Collection Following Cranioplasty after Decompressive Craniectomy for Traumatic Brain Injury. Korean J Neurotrauma 2016; 12(1): 6–10.
9. Syed MA, Sarmast AH, Kirmani AR, Bhat AR. Cranioplasty: Indications, procedures, and outcome – An institutional experience. Surg Neurol Int 2017; 8: 91.
10. Qiu S, You W, Wang H, Zhou X, Yang X. Allergic Epidural Effusion Following Polyetheretherketone Cranioplasty. J Craniofac Surg 2019; 30(3): 241–243.
11. Nguyen HS, Doan N, Wolfla C, Pollock G. Fenestration of bone flap during interval autologous cranioplasty. Surg Neurol Int 2015; 6: 190.
12. Nagy A, Bognar L, Pataki I, Barta Z, Novak L. Ventriculosubgaleal shunt in the treatment of posthemorrhagic and postinfectious hydrocephalus of premature infants. Childs Nerv Syst 2013; 29(3): 413–418.
13. Schuss P, Vatter H, Marquardt G, Imöhl L, Ulrich CT, Seifert V, Güresir E. Cranioplasty after Decompressive Craniectomy: The Effect of Timing on Postoperative Complications. J Neurotrauma 2012; 29(6): 1090–1095.
14. Honeybul S, Ho KM. Cranioplasty: morbidity and failure. Br J Neurosurg 2016; 30(5): 523–528.
15. Munivenkatappa A, Agrawal A, Shukla DP, Kumaraswamy D, Devi BI. Traumatic brain injury: Does gender influence outcomes? Int J Crit Illn Inj Sci 2016; 6(2): 70–73.
16. Sobani ZA, Shamim MS, Zafar SN, Qadeer M, Bilal N, Murtaza SG, Enam SA, Bari ME. Cranioplasty after decompressive craniectomy: An institutional audit and analysis of factors related to complications. Surg Neurol Int 2011; 2: 123.
17. Gooch MR, Gin GE, Kenning TJ, German JW. Complications of cranioplasty following decompressive craniectomy: analysis of 62 cases. Neurosurg Focus 2009; 26(6): E9.
18. Park JS, Lee KS, Shim JJ, Yoon SM, Choi WR, Doh JW. Large Defect May Cause Infectious Complications in Cranioplasty. J Korean Neurosurg Soc 2007; 42: 89–91.